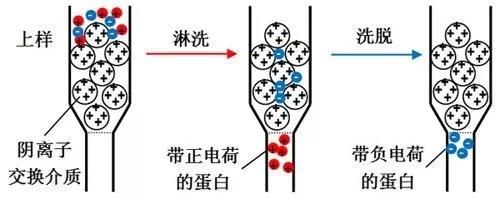
现如今,无论是实验室需要,还是在蛋白类产品在工业制备和生产的过程中,蛋白表达后进行提取纯化是非常重要的一个过程,分离的规则是根据不同蛋白的差异度和相似度进行处理,从而保证目标蛋白的高质量产出,减少杂蛋白对产品的影响。 蛋白纯化的步骤 纯化蛋白的方法很多,从最初的蛋白提取液粗样品开始,经过一系列的粗细分离步骤,逐步提高蛋白的纯化度,在不断重复的实验步骤中,获得纯度极高的蛋白质产品。 一般的蛋白纯化分离步骤包括: 当我们获得含有一些多糖、核酸、细胞碎片等杂质的蛋白质粗制提取液后,首先就要选用合适的方法,将我们不需要的杂蛋白和其他物质分离出去,这一步的分离不用过于精细,使用常规的等电点沉淀、盐析和有机溶剂分级分离等方法即可。这几种方法的特点是简单方便,处理量大,既能浓缩蛋白溶液,又可以除去大量杂质。在工业中一些蛋白提取液体积较大,又不适用于用沉淀或盐析法进行浓缩处理,我们便可采用凝胶过滤、超过滤、冷冻真空干燥或其他方法进行浓缩提纯。 样品经过粗分级分离之后的溶液体积会明显变小,其中含有的杂蛋白和其他杂质多数已被除去,之后一般会使用色谱法来进行第二次的精细分离。细分级分离的方法一般规模较小,但分辨率很高。细分离方式包括离子交换色谱、吸附色谱,凝胶过滤以及亲和色谱等。必要时还可选择区带电泳,等电点聚焦电泳等方式作为最后的纯化步骤。 蛋白质分离纯化的最后一步就是形成结晶,只有某种蛋白在溶液中的数量占有极大优势时才会形成相应的蛋白结晶。重结晶可除去少量夹杂的蛋白,因此结晶的过程本身也伴随着一定程度的纯化。由于结晶的过程中从未出现过蛋白质变性的现象,因此蛋白也不会在此过程中被破坏。 图1. 蛋白结晶图示 离子交换色谱的原理 使用离子交换色谱进行细分级分离是较为常见的一种蛋白纯化方式。它是根据蛋白质的电荷不同来分离蛋白质混合物,被分离的目的蛋白所携带的电荷能与离子交换剂中所带的相反电荷相结合,而且这两者之间的结合作用是可逆的,通过逐渐增加离子强度或改变洗脱液PH值的方式处理色谱柱,离子交换剂上结合的目的蛋白便可与洗脱液中的离子发生交换而被洗脱到溶液当中。 由于不同蛋白质的电荷不同,其与离子交换剂的结合能力也不同,所以根据蛋白洗脱到溶液中的先后顺序来进行提取,就可以轻松分离出我们需要的目标蛋白。 图2. 离子交换色谱的过程 什么是离子交换剂? 离子交换剂是由具有网状结构的不溶于水的高分子聚合物构成,其骨架上含有很多共价结合的带电基团,如果基团的侧链带有正电荷,就可以与溶液中的负离子结合,称之为阴离子交换剂,可以吸附带负电荷的蛋白质。如果基团侧链带有负电荷,则可以与溶液中的正离子相结合,称为阳离子交换剂。这就如同一个带有N端磁铁吸附能力的筛子,将与它可以结合的,带有S端的铁粒子吸附在筛子上,而带了与其相同磁性的N端铁粒子则由于排斥作用漏出筛子,从而分离出S端铁粒子和N端铁粒子。 离子交换剂的介质种类还可分为离子交换树脂、离子交换纤维素和离子交换凝胶等。强离子交换树脂保持离子化的PH值范围较宽,而弱离子交换树脂若想保持离子化,就只能在很窄的PH值范围内进行处理。离子交换色谱的优点是具有极高的分辨率,因此可以通过放大规模的方式直接应用于工业生产中。根据数据统计结果可知,大多数蛋白质的静电荷是为负值,因此阴离子交换色谱的应用在纯化蛋白领域的最为广泛。 如何选择合适的实验材料 选择离子交换介质时,首先要考虑的一点就是目的蛋白的分子大小,因为蛋白分子的大小不但会影响介质上的带电基团,还会影响介质对蛋白分子的动力载量,从而影响分离的效果和速度。 聚苯乙烯离子交换剂等疏水性较强的离子交换剂介质一般常用于分离小分子物质,例如无机离子、氨基酸、核苷酸等。而纤维素、葡聚糖、琼脂糖等离子交换剂介质的亲水性较强,并且具有较大的表面积和松散的亲水性网状结构,所以更适合于分离蛋白质等大分子物质。 纤维素离子交换剂通常适于初步分离和大量制备工业,虽然介质的价格较低,但分辨率和稳定性也相对较差。 葡聚糖离子交换剂的分辨率和价格都比较适中,但其介质容易受到外界环境的影响,随离子强度和pH值变化,介质的体积也会有较大改变,从而影响蛋白的分辨率。 琼脂糖离子交换剂介质的稳定性好,分辨率也很高,但价格偏贵,分离时间也比较长,因此不常用于大规模的蛋白工业生产。 离子交换剂介质的颗粒大小也会对蛋白的分离效果有一定的影响。离子交换剂颗粒一般呈球形,颗粒的大小通常以目数(mesh)或者颗粒直径(mm)来表示,目数越大表示直径越小。一般来说颗粒越小,分辨率越高,但同时离子装柱时的平衡时间会变长,流速也会减慢,而颗粒大则相反。所以大颗粒的离子交换剂更适合于对分辨率要求不高的大规模工业制备性分离,而小颗粒的离子交换剂则适用于实验室中需要高分辨率的蛋白分析或分离。 离子交换色谱的流动相必需是具有一定离子强度并对PH有一定缓冲能力的溶液,为了防止目的蛋白失活或变性,流动相的PH值需要尽量保持一定程度的稳定性,使其在色谱过程中不会发生明显的变化,从而稳定目的蛋白分子上的电荷量,保证色谱结果的准确性。起始缓冲液的浓度应当尽可能低(<100mmol/L),这样可以使色谱柱中的介质吸附更多需要分离的物质,缓冲液中应当不含会影响被分离物质活性和溶解度的成分。 离子交换色谱通常选用粗短柱,即高径比小的色谱柱,典型的离子交换色谱柱高度在5-20CM,高径比一般小于5。如果需要增加离子交换剂的体积,只能增加色谱柱的直径而不能增加其高度。如果是进行连续梯度洗脱,才可以适当增加色谱柱的长度。 图3. 各种大小的色谱柱图示 离子交换结束后的洗脱过程可以采用保持洗脱液成分一直不变的方式进行分段洗脱,也可以采用改变洗脱的盐浓度或(和)pH的方式洗脱,这种方式又称为跳跃式洗脱或渐进式梯度连续改变洗脱。梯度洗脱一般分离效果好,分辨效率高,特别是使用交换容量小,对盐浓度敏感的离子交换剂时,但对于蛋白类产品而言,在洗脱时尽量不要采用PH梯度法进行洗脱,因为这种方法可能会对蛋白产品产生一定影响,导致蛋白结构发现变化。因此逐步增加离子强度的洗脱方法在处理蛋白产品中出现的较多一些,可以降低很多不必要因素的影响,提高纯化效率。 选择好合适的离子交换色谱材料后,通过预处理装柱、色谱柱平衡、加样、洗脱的全过程,就可以得到纯度极高的目标蛋白产品。若一次色谱后的纯度依旧不理想,还可以进行多次重复实验,以保证目标蛋白的高纯度提取。 安必奇专业团队致力于提供蛋白质表达和纯化的先进工具、利用多功能和可靠的蛋白质表达平台,适应从几毫克到几百克的不同规模的蛋白质生产。我们已经可以向客户提供了3,000多种蛋白的生产产品。如果对我们的蛋白质表达与纯化服务和GMP蛋白生产服务感兴趣,欢迎随时联系,谢谢。 参考文献: 1. 佚名. 蛋白质纯化技术及应用[M]. 2005. 2. 陈浩, 陈于红, 朱德煦,等. 重组蛋白质纯化技术[J]. 中国生物工程杂志, 2002, 22(5):87-92. 3. 徐其进中, 黄骏雄. 蛋白质分离与纯化过程中高效离子交换色谱柱的再生[J]. 分析化学, 2000, 1(1):46-49. 4. Walton H F . Ion Exchange Chromatography[J]. Analytical Chemistry, 1968, 40(5):51R-62R.

转载自公众号:北京安必奇生物科技有限公司

如何选择离子交换色谱进行蛋白纯化?
作者:北京安必奇生物科技有限公司 2019-09-16T12:00 (访问量:11362)
北京安必奇生物科技有限公司 商家主页
地 址: 北京市通州区经海五路1号院22号楼
联系人: 章先生
电 话: 400-008-6094
传 真:
Email:info@abace-biology.com
相关咨询
安必奇生物提供新冠病毒研究解决方案 (2020-04-03T12:06 浏览数:31127)
喜讯|安必奇生物新冠病毒诊断试剂盒通过欧盟CE认证 (2020-04-03T12:06 浏览数:32905)
新冠病毒如何感染人类细胞?安必奇推出防病毒保护剂 (2020-04-03T12:04 浏览数:28298)
新冠肺炎诊断的“C位”之争?安必奇诊断产品来助力 (2020-04-03T11:59 浏览数:30060)
Science封面新文章揭示新冠病毒人体蛋白受体结构 (2020-04-03T11:03 浏览数:32793)
【一起学】农杆菌浸花法如何转化拟南芥? (2020-03-19T11:16 浏览数:45114)
如何利用CRISPR/Cas9构建稳定敲除细胞系? (2020-02-14T15:35 浏览数:35226)
荧光原位杂交技术全攻略 (2020-02-14T15:17 浏览数:37904)
【新产品】安必奇生物供应新型冠状病毒科研用ACE2蛋白 (2020-02-06T10:38 浏览数:30142)
安必奇成立专项工作组研发新冠病毒治疗和快速检测方案 (2020-02-06T10:14 浏览数:28638)
