表观遗传学是研究基因的核苷酸序列不发生改变的情况下,基因表达的可遗传的变化的一门遗传学分支学科。DNA甲基化(DNA methylation)、组蛋白修饰(histone modification)、基因组印记(genomic imprinting)、RNA编辑(RNA editing)、基因沉默、核仁显性、休眠转座子激活和性别相关性基因剂量补偿效应等都是典型的表观遗传现象。表观遗传调控研究技术分为转录前调控研究技术和转录后调控研究技术。转录前调控研究技术主要包括:MSP、BSP、ChIP、EMSA、DNA Pull down、酵母单杂交(Y1H);转录后调控研究技术主要包括RIP、RNA Pull down 、双荧光素酶报告系统等。
本文以《RUNX1 regulates site specificity of DNA demethylation by recruitment of DNA demethylation machineries in hematopoietic cells》一文为例从转录因子甲基化调控角度为您介绍表观遗传的技术方法和思路的应用。
文章概要:RUNX1在造血细胞发生过程中是一个关键的转录因子,同时在免疫功能中扮演着重要的角色。尽管以前对RUNX1的基因表达调控机制进行了大量的研究,但是关于RUNX1在表观遗传调控中的作用知之甚少。本文证明了RUNX1在人类造血细胞中直接促进了结合位点的去甲基化。然而在DNA复制阻滞的细胞里面RUNX1同样发挥去甲基化的作用,说明了RUNX1激活了相关的去甲基化机制。同时,免疫共沉淀实验验证了RUNX1与DNA去甲基化酶(TET2/TET3/TDG)的相互作用。染色质免疫共沉淀(ChIP-seq)技术揭示了RUNX1和TET2在相同基因组区域的共定位。最后,运用甲基化组分析了造血细胞发生过程中去甲基化区域RUNX1结合位点的分布。
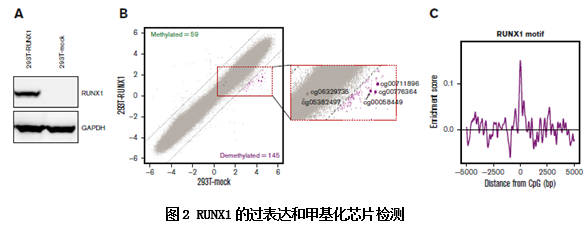
为了研究RUNX1与对甲基化的调控作用,作者在细胞中过表达RUNX1,采用芯片技术检测了异位表达RUNX1的细胞的DNA甲基化水平。作者鉴定了145个去甲基化位点和59个甲基化位点,同时发现异位表达的RUNX1促进了RUNX1位点的去甲基化。通过RUNX1的结合基序,设计TF-binding motif过表达实验,证明了RUNX1结合基序主要出现在去甲基化区域,而不是在甲基化区域,证明了RUNX1是通过位点结合来定位去甲基化区域的。
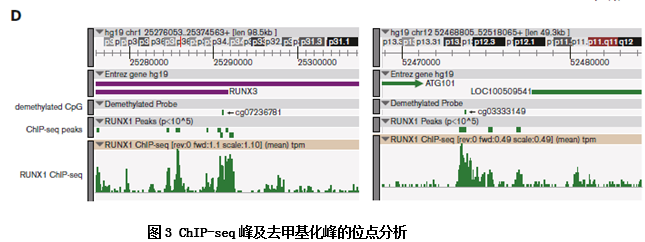
进一步的ChIP实验验证了RUNX1结合位点和去甲基化CpG岛的结合位点的重合性及。
而更直接的重亚硫酸盐测序结果也显示过表达的RUNX1促进了PTPN22和RUNX3的去甲基化。
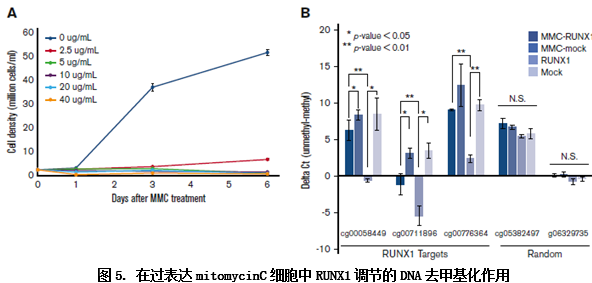
以上这些方法都显示了RUNX1通过位点特异性结合来定位去甲基化区域的。那么RUNX1引导位点特异性去甲基化与DNA的合成有无关系呢?作者采用了DNA合成阻滞剂mitomycin C处理细胞,qMSP(实时定量甲基化测序)检测在DNA阻滞的情况下DNA关键位点的甲基化情况,发现RUNX1引导的特定位点甲基化有受DNA复制影响和不受DNA复制影响两种机制的共同作用。
甲基化分为主动的去甲基化和非主动的去甲基化,主动的是位点特异性指导的,而被动的去甲基化则是在去甲基化相关酶作用下进行的。以上是RUNX1主动去甲基化的研究,作者进一步研究了RUNX1在主动去甲基化中的作用:TET蛋白在主动去甲基化中发挥重要作用,作者首先研究了RUNX1与TET的相互作用,发现TET可以促进RUNX1调节的DNA的去甲基化作用。
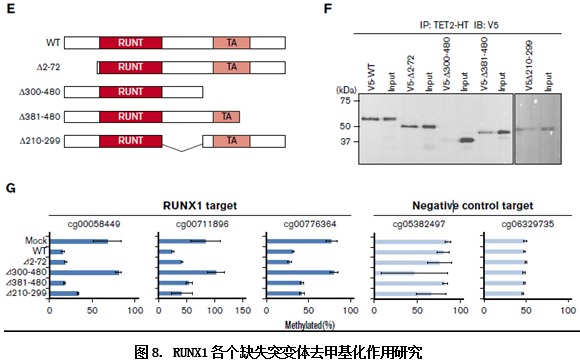
而它们作用的机制如何,作者进一步通过分子互作技术CO-IP和缺失突变的RUNX1进一步做了如下的研究。
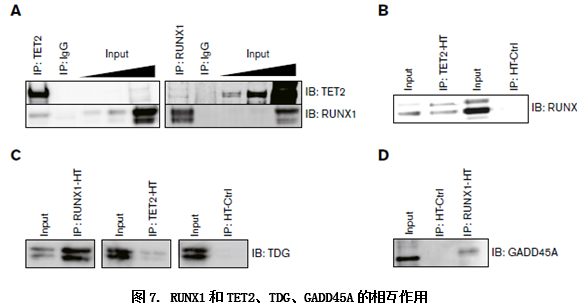
CO-IP(HT)技术证明了RUNX1与TET2、TDG、GADD45A是相互作用的。RUNX1哪个区段在这个过程中起作用?作者构建了RUNX1缺失突变体,用CO-IP和qMSP技术分别检测了不同突变体的去甲基化作用,弄清了RUNX1中各个功能区段发挥的作用.
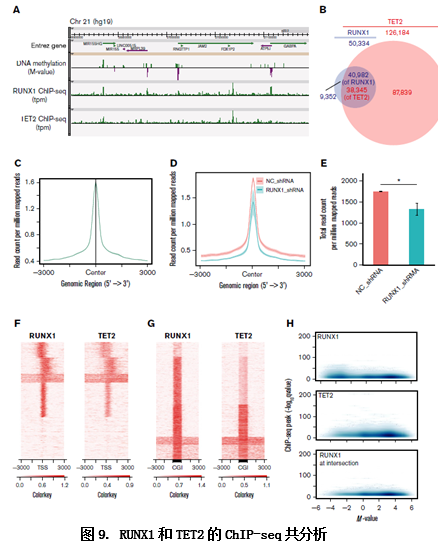
RUNX1可以和TET2相结合,那么RUNX和TET2相结合是否共同定位于特定位点而促进去甲基化作用的呢?作者进一步做了RUNX1和TET2的ChIP-seq实验,验证了两者ChIP峰的高度重叠,证实了两者基因组水平的共定位去甲基化作用。
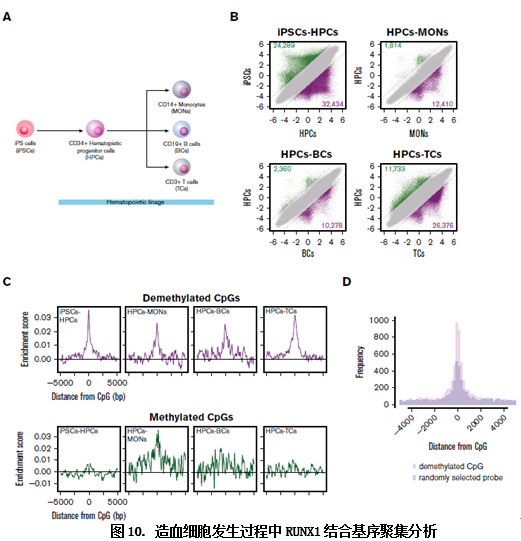
这样作者对RUNX1的去甲基化机制做了较详尽的阐述,回到造血细胞的分化过程,作者对造血细胞发生过程做了全基因组的甲基化分析,发现RUNX1结合位点在造血细胞发生过程中显著性地聚集在去甲基化区域,RUNX1在造血细胞发生过程中通过去甲基化作用促进了相关的过程。
文章总结:作者补充研究RUNX1的非转录子作用,首先通过过表达和芯片技术验证了RUNX1的去甲基化作用,并且通过ChIP-seq、BSP、MSP等技术证明了RUNX1通过结合特定的序列指导DNA的去甲基化作用。然后,从去甲基化的途径出发,作者接着从主动去甲基化出发,通过CO-IP实验验证了RUNX1是与关键分子TET2等的相互作用,TET2促进了RUNX1的去甲基化作用,找到了RUNX1去甲基化的作用途径。最后,通过芯片等技术,作者从甲基化功能角度对造血细胞发生过程进行了由RUNX1指导的甲基化调控作用的研究,证实了RUNX1指导的全基因组的甲基化在造血细胞发生过程中具有重要的作用。
文章中主要使用的实验方法:
1. 细胞培养、转染
2. 甲基化芯片检测与甲基化分析
3. 甲基化位点检测:ChIP-seq、qBSP、qMSP
4. 病毒包装与感染
5. 分子检测、互作:q-PCR、WB、CO-IP、HT-CO-IP(标签)
6. 突变基因合成、基因敲除
解析文献:
Suzuki T, Shimizu Y, et al. RUNX1 regulates site specificity of DNA demethylation by recruitment of DNA demethylation machineries in hematopoietic cells. Blood advances, 2017, 1(20):1699-1711.
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:7834)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:8601)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:10209)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:7671)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:6711)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:7884)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:11870)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:8666)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:7106)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:7568)