基本信息
题目:Digestion-ligation-only Hi-C is an efficientand cost-effective method for chromosome
conformation capture
期刊:Nature Genetics
影响因子:31.694
主要技术:DLO Hi-C、原位DLO Hi-C、HCR、高通量测序、生信分析
研究背景
基因组的三维结构对DNA的复制、损伤修复及转录调控起着至关重要的作用。通过探索染色质间的远程调控作用,可以鉴定得到调控元件的未知靶基因。
虽然Hi-C有助于揭示基因组的三维结构,但是有一些因素限制了它的扩大应用,比如复杂繁琐的实验流程、随机自连的DNA片段带来的高噪声以及缺乏简单明确的噪声评估方法。Hi-C后来也衍生出了一些改进技术,比如TCC、原位Hi-C、micro-C、RTCC、DNase Hi-C、targeted DNase Hi-C以及capture Hi-C。虽然这些先进的方法推动了染色体构象捕获技术的发展,但是从提高信噪比、简化实验流程,同时降低实验和测序成本来讲,我们仍然任重道远。
在本研究中,作者找到了一种方法,这种方法通过简单的酶切酶连步骤,取代了之前的生物素标记然后拉取DNA片段的方法。更为重要的是,引入了一种早期的质控方法,可以在测序前快速检测随机自连的噪声比例,通过该方法,可以极大的降低实验所需时间和花费,正是因为这些改进,我们将DLO Hi-C用于研究K562细胞系的基因组三维结构。
研究结果
1. DLO Hi-C的理论验证
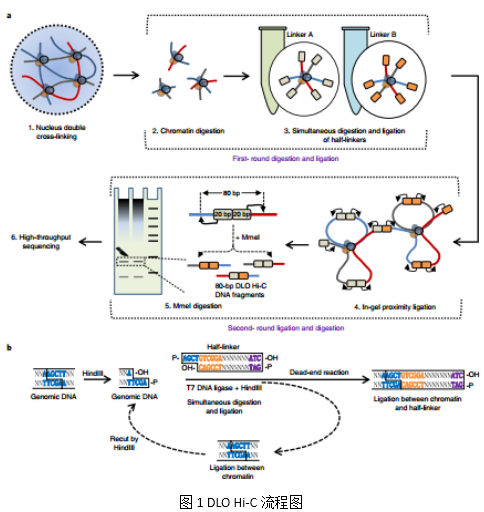
DLO Hi-C首先通过对细胞进行双交联,被固定的染色质紧接着被限制性内切酶消化,然后再将酶切消化后的染色质分别加上两种不同的20bp的接头(接头A和接头B)。为了防止不同染色质分子间的自连,作者设计了同步酶切与酶连,正因为如此,所有的染色质片段与接头的连接都是不可逆的。(Fig. 1)。
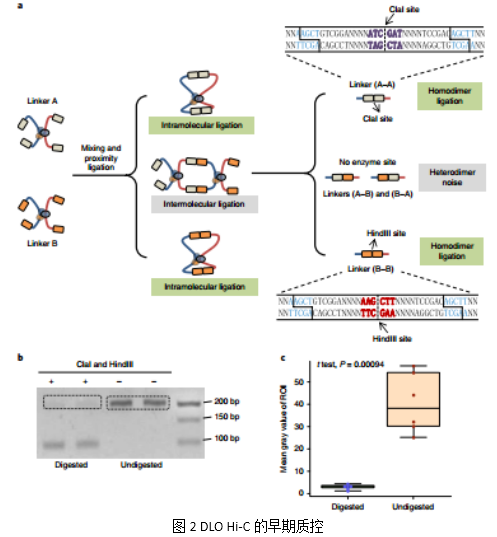
2. 测序前的快速质控
为了在测序前评估随机连接的噪声情况,作者在DLO Hi-C流程中引入了早期质控步骤,设计了两个不同的接头A和接头B,如果连接发生在染色质内的交联复合物中,将形成A-A或者B-B结构。如果连接发生在不同分子中(随机连接),形成的A-B或者B-A结构将不含有任何酶切位点。因此,可以通过酶切对得到的DLO Hi-C DNA片段进行消化处理,以此来评估随机连接的比例。经过定量检测发现92%的 DLO Hi-C 文库DNA被酶解了,这也证实了DLO Hi-C 文库的信噪比很高(Fig. 2)。
3. DLO-HiC/原位Hi-C与其它Hi-C技术的比较
在高通量测序后,结合生信分析,检测了A-A、B-B以及A-B、B-A连接所占的比例,结果显示只有3.0%的测序序列是A-B或者B-A连接,这个结果也与上面的早期质控结果相近。在其它Hi-C方法中,是没有办法评估分子间的连接概率的。
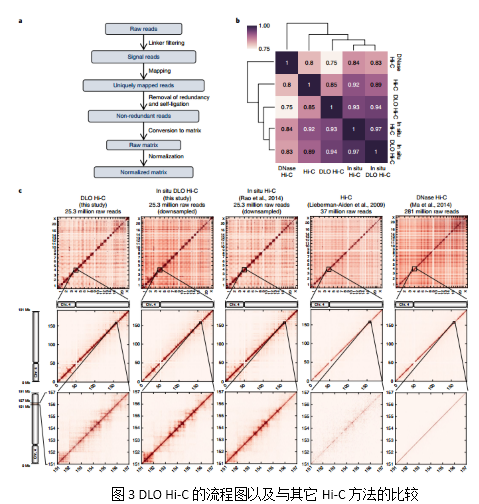
为了更好的评估DLO-HiC的质量,作者利用K562细胞系比较了DLO Hi-C, 原位DLO Hi-C以及其它的Hi-C 方法(original Hi-C, DNase Hi-C以及原位Hi-C)在其基因组三维结构上的差别。经过分析发现,虽然它们具有不同的噪音水平和测序深度,但是却发现了相似的互作关系(Fig. 3)。
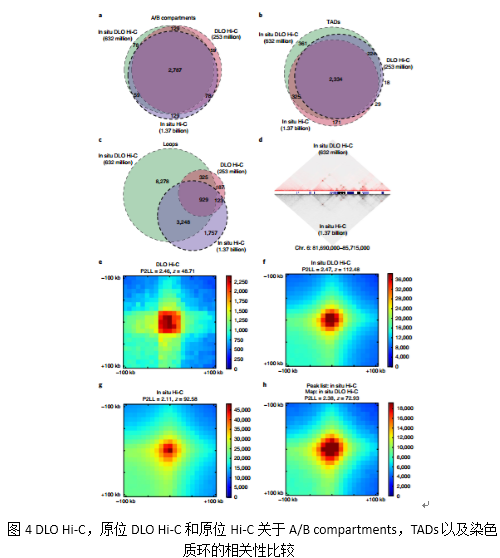
同时作者也比较三种Hi-C方法(DLO Hi-C :253 million raw reads, 原位DLO:632 million raw reads以及原位Hi-C:1.37 billion raw reads)关于A/B compartments、TADs和chromatin loops(染色质环)的分析,这三种分析方法在A/B compartments和TADs分析上具有高度的一致性。通过原位DLO Hi-C方法,从632million的原始序列中鉴别到了12780个loops,这里面有4177个通过原位Hi-C也可以鉴定得到。此外,作者做了APA分析三种方法的信噪比,结果显示原位DLO Hi-C相对来说具有较高的信噪比(Fig. 4)。
讨论
染色体构象捕获技术在过去十年中有了很多改进,并极大的推动了基因组三维结构的研究。 自原位Hi-C技术发明以来,Hi-C文库的信噪比不断增加。在这项研究中,作者开发了另一种Hi-C方法,即仅需要消化连接的Hi-C,这项技术仅需要在主要实验步骤中进行两轮消化和连接以探索3D基因组结构。作者利用这项技术成功的探索了基因组的三维结构和染色体易位,这项技术有助于探索全基因组的三维结构以及相关的研究。
DLO Hi-C的三个主要优势:
1. DLO Hi-C是一种简单且高效的实验方法。
当前Hi-C方法有一些限制包括复杂和昂贵的Hi-C文库构建过程和高测序成本。通过DLO Hi-C,只需执行两轮简单的消化和连接步骤即可获得高质量的文库。
2. 高信噪比。
降低背景噪音是Hi-C实验中的主要挑战之一。 DLO Hi-C使用多种措施来减少噪音。首先,作者对染色质进行双交联。其次,在接头连接步骤中,使用限制性内切酶(如HindIII)和DNA连接酶同时消化和连接染色质片段和DNA接头。通过同时执行这些步骤,几乎可以完全避免不同染色质片段之间的连接。最后,目前的Hi-C方法通过珠子拉下生物素标记的DNA片段来去除DNA噪音,这也导致会拉下非邻近连接环化的生物素标记的悬挂末端并产生噪声数据。
3. 快速的早期质控
使用DLO Hi-C方法,可以直接评估随机连接噪声的水平,只需在深度测序前用限制性内切酶消化最终文库即可。该步骤只需要2小时进行酶消化和DNA电泳。在DLO Hi-C方法中,早期的质量控制步骤使我们第一次了解高通量测序前随机分子间连接噪声水平的评估。
借助DLO Hi-C方法的优势,作者成功将其应用于K562和THP-1细胞系,以揭示其三维基因组结构并鉴定出染色体易位。此外,DLO Hi-C可以在没有参考基因组的情况下评估噪音。通过这种方式,可以使用高精度的DLO Hi-C数据来协助未知物种和宏基因组研究的基因组组装。DLO Hi-C方法也可用于研究三维基因组结构、远程基因调控和染色体易位。
总之,作者成功开发了一种简单、低成本、低噪音的DLO Hi-C技术,可用于全基因组染色体构象捕获。这项技术为进一步探索基因调控和三维基因组结构铺平道路,同时还可以促进基因组组装、染色体易位分析和宏基因组学研究。
如何低成本研究空间转录组?看完这篇文章你或许会有答案
(2022-06-02T14:51 浏览数:5486)
【周二晚八点】从位置到功能--空间转录组应用
(2022-05-16T08:59 浏览数:6284)
Cell Reports:利用空间转录组解析哺乳动物精子生成
(2022-04-28T14:54 浏览数:7351)
RNA二级结构调控基因表达的研究现状和进展
(2022-04-21T13:39 浏览数:5409)
Nature: MERFISH绘制小鼠初级运动皮层空间细胞图谱
(2022-04-18T13:24 浏览数:4159)
大自然的恩赐-外泌体药载
(2022-04-08T13:43 浏览数:5744)
【详解】基于图像的单细胞空间分辨转录组学技术
(2022-04-01T11:18 浏览数:9711)
知无不“研”,五分钟带你了解空间分辨转录组学的前世今生
(2022-03-18T14:00 浏览数:6510)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5009)
唾液外泌体与临床疾病的关联研究
(2022-03-11T16:36 浏览数:5529)