从微孔板检测至Westerns定量:全面探索细胞热应激反应
简介
许多手段可以帮助研究者来探索细胞的各种反应过程,并且可从中获得其大量的生物学信息,如细胞成像、基于细胞的活力检测和增殖检测等。Western Blot(即蛋白质免疫印迹法)不仅可用于观察蛋白质表达情况的变化。通常情况下我们需要多台仪器协同工作才能够获得足够多的信息,当然整个过程我们也不得不需要掌握更多种不同的软件。
此篇应用文章我们展示出如何仅利用一台仪器,即SpectraMax® i3多功能检测平台就可以完成对许多细胞相应参数的收集和处理,我们用热应激反应作例来展示不同检测方式特点,包括成像和Western Blot功能,多重手段方便我们观察细胞内不同反应过程带来的不同变化。
众所周知正常细胞长时间暴露在高温环境下会引起细胞凋亡,同样也会提高细胞HSP70(Heat Shock Protein)的表达量。我们将CHO-K1细胞置于两种不同的生长环境下,即健康环境和压力环境,首先将两种环境下的细胞经过热激处理以后,我们利用SpectraMax® i3多功能检测平台的细胞成像功能去检测其细胞增殖、活力和凋亡的情况。我们也可利用ScanLaterTM Western Blot检测系统获得的数据经分析后发现,HSP70表达量与热激反应成正相关性。
优势
· 无需任何染料分子即可以检测细胞增殖
· 荧光染料标记成像后可用于探究细胞死亡机制
· 细胞成像,基于细胞功能实验以及Western Blot检测都可以通过同一平台来实现
材料
· CHO-K1细胞(ATCC P/N CCL-61)
· 细胞培养基(Ham’s F12中加入10%胎牛血清和1%的双抗)
· 黑色,底透细胞培养微孔板(Corning P/N 3603)
· SpectraMax i3微孔板读板机
· SpectraMax MinMaxTM 300细胞成像系统
· EarlyTox Cell Integrity试剂(Molecular Devices P/N R8213)
· CellEvent Caspase-3/7绿色检测试剂(Life Technology P/N C10423)
· ScanLater Westen Blot检测系统
· ScanLater抗鼠检测试剂盒-铕元素标记羊抗鼠的二抗
· ScanLater Western Blot检测卡盒
· 抗HSP-70鼠源单抗(R&D检测系统P/N MAB1663)
· Immobilon-FL膜, 0 . 4 5 μ m 孔径(EMD Millipore P/N IPFL 00010)
方法
预先处理两份CHO-K1细胞,分别将其处于健康环境和压力环境。健康细胞为定期更换培养基而且传代过程保证其汇合度不高于80%,然而压力环境下的细胞不经常更换培养基且汇合度较高时才进行传代处理。
进行热激反应前一天,我们分别将健康环境下培养细胞和压力环境下培养细胞铺在黑色底透96孔板中,密度为7500细胞/孔,采用黑色底透的细胞培养微孔板的目的是便于细胞成像和细胞功能学实验。针对于West e r n Blot样品准备,预先以225,000细胞/每孔的密度铺于6孔细胞培养板中。第二天,我们将一半的细胞进行热激处理,即置于45°C环境下90分钟,热激处理后, 将细胞立刻放置于SpectraMax MiniMax 300细胞成像系统下,并利用其透射光通道观察细胞形态的变化。经热激反应6小时和24小时后,利用系统成像功能再次观察 细胞形态学变化以及增殖情况。StainFree™ 技术(免标记分析技术)无需染料分子既可以检测每孔中细胞的数目。
利用细胞功能学实验分析细胞凋亡和细胞活力情况,探索热激反应能否诱导凋亡或者其他细胞死亡通路,观察健康环境下培养的细胞和压力环境下培养的细胞是否有不同的表现。CellEvent试剂用于热激处理后细胞凋亡的检测,Molecular Devices® EarlyToxTM Cell Integrity试剂盒可用于区分活细胞与死细胞。两种检测分别在其热激反应后的第6小时和第24小时。
对于Western Blot检测,细胞置于6孔板中进行培养,我们用胰酶消化细胞后,用含有0.5%Tween和蛋白酶抑制剂的PBS缓冲液来清洗和溶解细胞,然后离心,上清液进行蛋白定量检测,我们将2.1ug细胞提取物,上样于4-20%浓度的胶中,然后再将蛋白转移至PVDF膜上,一抗采用鼠源的抗HSP-70抗体,二抗采用铕元素标记抗鼠的二抗,我们利用SpectraMax i3检测平台组合ScanLater Western Blot检测卡盒对蛋白条带进行定量检测。
细胞增殖
热激反应后,在进行细胞成像和其他实验前,我们先将细胞经过6小时和24小时恢复性生长。然后分别在这两个时间点,利用StainFree技术在SpectraMax MiniMax300细胞成像系统上对细胞进行计数分析,无需染料既可以利用软件优势识别细胞并对其进行计数。利用SoftMax® Pro软件中预置程序识别细胞,分析热激反应后细胞增殖下降的情况,尤其是压力环境下处理的细胞,观察发现,24小时候后细胞增殖下降的情况更加明显(图一)。

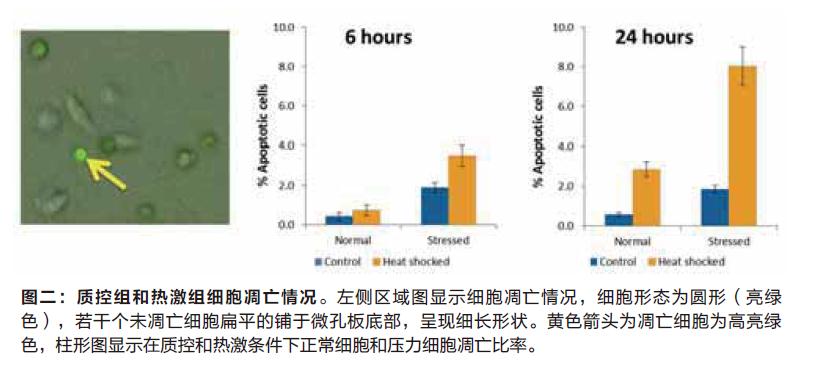
凋亡实验
在6小时和24小时的两个时间点,对细胞凋亡情况进行检测,热激反应的第6小时,压力环境下的细胞凋亡百分率会更高,随后第24小时我们发现压力环境下培养的细胞其凋亡情况更加明显(图二)。比较后我们发现,未经过热激处理的细胞比较稳定且凋亡细胞比率较低。
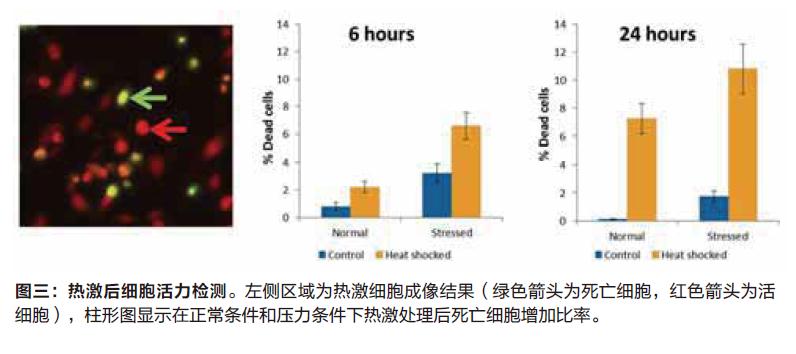
细胞活力实验
利用EarlyTox Cell Integrity试剂盒来检测细胞是否死亡,热激反应后我们发现死亡细胞数目明显增加,尤其是在第24小时后,压力环境下的细胞比健康环境下的细胞死亡比率更高。这个结果与凋亡检测结果相一致,可以说明全部或者大部分的细胞死亡结果是由于细胞凋亡所引起的。
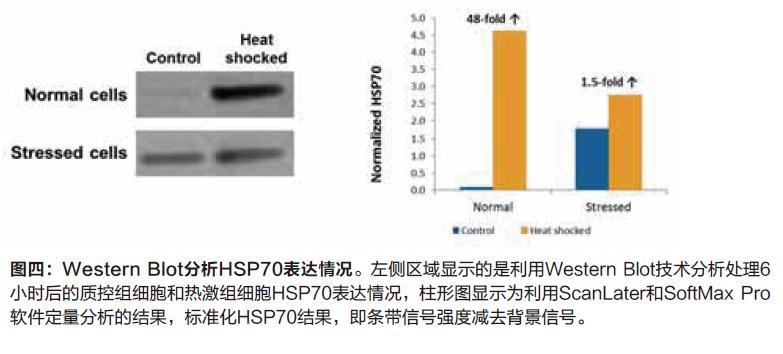
HSP70诱导
Scanlater Western Blot分析后揭示的结果如预期,经热激反应后HSP70诱导情况为在正常健康环境下处理的细胞的表达量更大。通过SoftMax 软件和Scanlater系统,我们可以针对条带强度进行定量分析,热激反应6小时后健康环境下的细胞HSP70表达量增加了48倍,但是在压力环境下其仅仅增加了1.5倍(图四)。未经过热激处理的压力环境下细胞其HSP70表达量较健康环境下的细胞高出18倍。
结论
利用SpectraMax i3多功能检测平台的细胞成像和Western Blots功能来研究热激处理后细胞的反应及变化情况。Stain-Free细胞计数功能来检测正常及压力细胞热激后增殖情况的变化,细胞凋亡和活力实验可以帮助我们了解热激诱导细胞死亡的机制。最后,利用其Western Blot功能来定量检测其热激细胞和质控细胞(未经过热激处理的细胞)诱导的HSP70含量。从细胞凋亡和细胞活力实验结果,我们假设全部或者大部分细胞的死亡是由于热激处理后引起的细胞凋亡。我们发现正常培养的细胞(无压力环境培养的细胞)热应激处理后诱导产生的HSP70量最高。而压力环境下培养的细胞在进行热激反应以前就已经表达HSP70,然后在热激反应后会进一步提高HSP70表达量。
然而, 压力环境培养下的细胞产生的HSP70量远低于健康环境下培养的细胞,结果揭示出压力环境下培养的细胞在凋亡过程中的保护机制要更低,所以可以观察到细胞凋亡比率会更高。我们现在仅需利用 SpectraMax i3检测平台和SoftMax Pro分析软件,就能够采用多种方式来探究细胞功能,而传统上实现这些检测会需要多台不同仪器和多款不同软件的配合使用才能够完成。
