2型糖尿病(T2D)晚期的核心病理特征是胰腺β细胞分泌功能障碍和凋亡增加,导致胰岛素分泌不足、血糖升高,但这一过程的潜在机制尚未完全阐明。分泌载体膜蛋白5(SCAMP5)在β细胞中的表达及功能未知,需明确其是否参与糖尿病β细胞功能衰竭。近期,深圳大学医学部孔祥臣研究团队在Advanced Science (IF 14.1) 在线发表题为“Deficiency of SCAMP5 Triggers Pancreatic β-Cell Secretory Dysfunction and Apoptosis”的研究论文,强调了ChREBP调控的SCAMP5在β细胞胰岛素分泌和凋亡中的关键作用,揭示了糖尿病状态下β细胞功能衰竭的一个此前未被发现的机制。

· 维真助力·
基因信息 分泌载体膜蛋白5(SCAMP5)
实验动物 糖尿病GK大鼠
病毒产品 AAV8-Insulin1-SCAMP5
注射方式 胆总管内注射
病毒用量 50μL,≈2×1012 virus particles
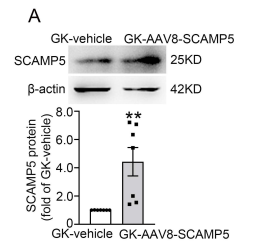
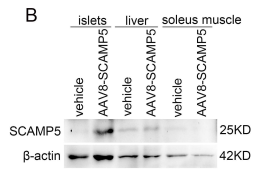
AAV8-Insulin1-SCAMP5增强了胰岛中SCAMP5的蛋白表达
01研究结果
1、SCAMP5是β细胞葡萄糖刺激胰岛素分泌的必需调控因子
研究数据表明糖尿病状态下,啮齿动物胰腺β细胞中SCAMP5的表达显著降低。为探索SCAMP5减少对胰岛素分泌的影响,研究者一方面构建了SCAMP5敲低的细胞系,评估结果显示SCAMP5敲低会损害葡萄糖刺激的胰岛素分泌。另一方面构建了β细胞特异性Scamp5敲除(cKO)小鼠,体外胰岛及体内整体的GSIS均受损,伴随葡萄糖耐受异常;经高脂饮食+STZ诱导模拟晚期T2D后,其血浆胰岛素水平更低、血糖控制更差。通过AAV8-Insulin1-SCAMP5靶向上调糖尿病GK大鼠胰岛的SCAMP5表达,可显著提升其葡萄糖刺激后的血浆胰岛素水平,改善葡萄糖耐受并降低血糖。
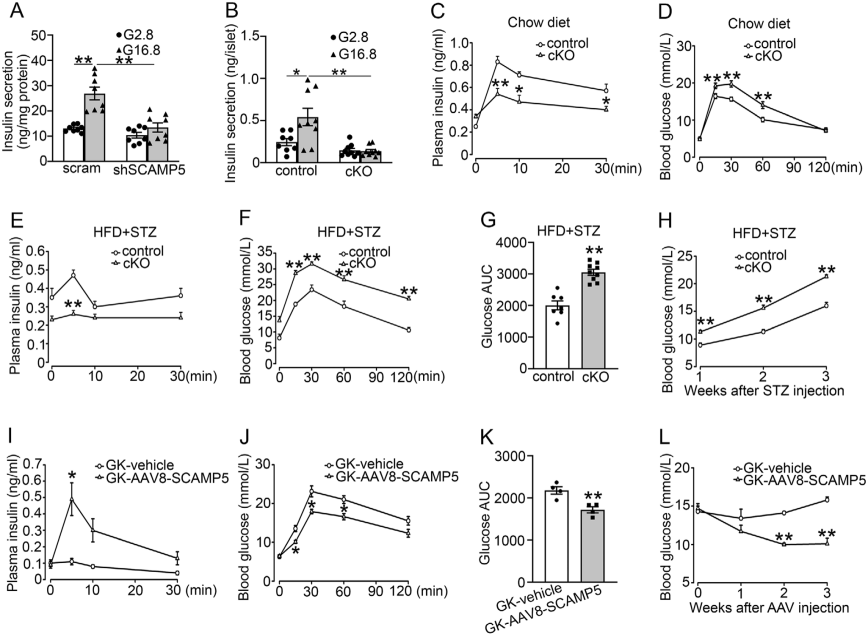
SCAMP5调节胰岛β细胞的胰岛素分泌
2、SCAMP5调控β细胞凋亡
为探究SCAMP5影响胰岛素分泌的机制,研究团队检测了其对Caᵥ1.2表达的作用,Caᵥ1.2是L型电压依赖性钙通道的孔道形成亚基,而该通道在胰岛素分泌中发挥关键作用。结果显示SCAMP5缺失下调Caᵥ1.2表达,而SCAMP5过表达则上调Caᵥ1.2表达。此外,Scamp5 cKO小鼠胰岛中,钙通道激动剂Bay K8644增强GSIS的效应显著减弱;AAV8-SCAMP5处理的GK大鼠胰岛中,Bay K8644对GSIS的增强作用明显增强。这些发现突出了CaV1.2在SCAMP5介导的胰岛素分泌调节中的重要作用。接着,研究团队探索了SCAMP5表达水平的改变对β细胞凋亡的影响,体内外数据均表明SCAMP5缺失促进β细胞凋亡,SCAMP5过表达抑制β细胞凋亡。
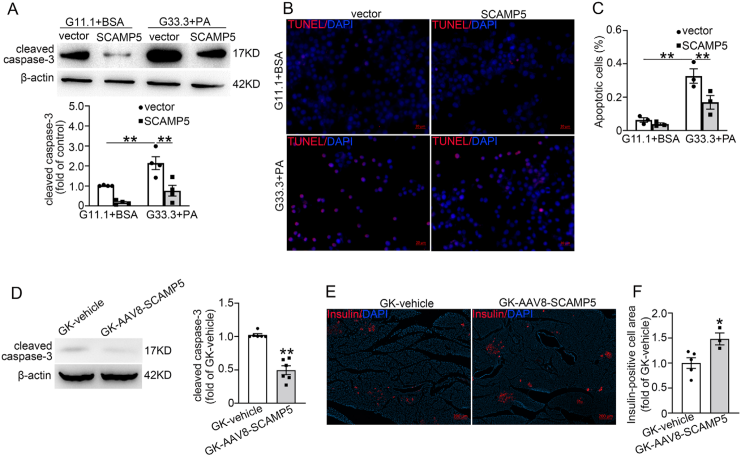
SCAMP5过表达抑制β细胞凋亡
3、SCAMP5缺失通过调控VDAC1,触发细胞色素c从线粒体释放到细胞质
通过检测shSCAMP5对线粒体膜电位的影响,发现SCAMP5缺失破坏线粒体功能,促进细胞色素c释放。位于线粒体外膜的电压依赖性阴离子通道1(VDAC1)已被证明可以介导线粒体释放细胞色素c,免疫荧光结果显示SCAMP5与VDAC1在细胞中共定位,免疫沉淀结果证实SCAMP5与VDAC1存在互作。此外,SCAMP5过表达降低VDAC1蛋白表达,SCAMP5缺失增强VDAC1蛋白水平,蛋白酶体抑制剂MG-132降低了shSCAMP5诱导的VDAC1蛋白上调,表明SCAMP5通过促进VDAC1蛋白降解(而非抑制转录)调控其表达。进一步研究显示VDAC1过表达会显著升高cleaved caspase-3水平,直接诱发凋亡,抑制VDAC1可逆转SCAMP5缺失的凋亡效应。SCAMP5缺失会增强VDAC1与促凋亡蛋白Bax的结合,并促进Bax从细胞质向线粒体转运,进一步加剧线粒体凋亡通路激活。通过探索糖尿病条件下SCAMP5表达降低的潜在机制,发现碳水化合物反应元件结合蛋白(ChREBP)在β细胞中通过表观遗传机制抑制SCAMP5的表达,且这一调控作用依赖高血糖激活。
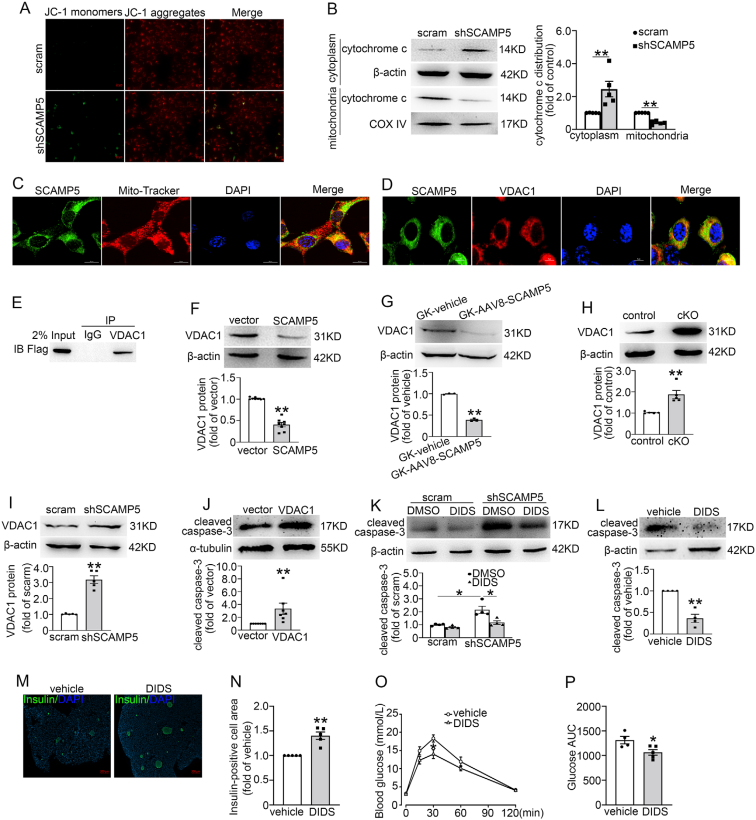
SCAMP5通过调节VDAC1触发线粒体细胞色c释放
02研究结论
研究结果表明SCAMP5表达降低会引发β细胞凋亡及分泌功能障碍。糖尿病状态下,高血糖诱导的ChREBP过度激活可能导致SCAMP5表达下调。高血糖或许通过调控ChREBP/SCAMP5通路诱发β细胞功能异常。这些发现不仅揭示了一种调控β细胞功能障碍的新途径,还凸显了SCAMP5作为2型糖尿病治疗潜在靶点的价值。
